AMINA
São compostos que possuem o nitrogênio
Podendo ser aminas:
Primárias: Ligada a UM carbono
Secundaria: legada a DOIS carbonos
Tercearia: ligada a TRÊS carbonos
NOMENCLATURA
(grupo funcional ligado ao nitrogenio) + amina
EX 
NOME DO COMPOSTO: fenilamina
Obs.: Os grupamentos ligados ao N devem ser colocados em
ordem alfabética.
AMIDAS
Caraterizado pelo grupo funcional:
NOMENCLATURA
Radical (se houver)+ cadeia principal( mesma regra dos hidrocarbonetos)+ amida
EX:

NOME DO COMPOSTO: 3-metil butan
AMIDA
Obs.: Um raciocínio mais fácil é acrescentar AMIDA ao
hidrocarboneto correspondente.
NITRILA
Sao identificadas pelo grupo:
R- CN sendo o R o grupo de radical ligado ao carbono
NOMENCLATURA:
Dá-se o nome do hidrocarboneto correspondente,
acrescentando-lhe a terminação NITRILA, (hidrocarboneto correspondente +
NITRILA).
EX:

Nome do composto: etanonitrila.
NITROCOMPOSTO
Identificados pelo grupo NO²
EX:

NOME DO COMPOSTO: 2,4,6 TRI
NITROFENOL
NOMENCLATURA
Usa-se o prefixo NITRO antecedendo o nome do hidrocarboneto
que origina o nitrocomposto (NITRO + hidrocarboneto correspondente)
EX:
HALETOS ORGÂNICOS
Compostos derivados dos hidrocarbonetos
pela substituição de um ou mais hidrogênios por halogênios(F, Cl, Br, I).
EX:

NOME DO COMPOSTO: tetracloreto de carbono
NOMENCLATURA:
O nome do halogênio antecede ao nome do hidrocarboneto como
se fosse um grupamento qualquer;
Obs.: Se na cadeia existir apenas halogênios como
ramificações, a numeração da cadeia se inicia pela extremidade mais próxima
destes, mas se existir qualquer outro grupo ligado a cadeia principal a
numeração se inicia pela extremidade onde seja possível se obter os menores
números possíveis.
OBS II : caso haja radicais como metil, etil e etc, e compostos da família dos halogênios a nomenclatura começa pelo halogênios e depois os demais radicais (tudo em ordem alfabética).

 NOME DO COMPOSTO: fenilamina
NOME DO COMPOSTO: fenilamina
 Nome do composto: etanonitrila.
Nome do composto: etanonitrila.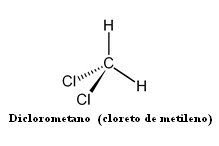
 PENTAN-2,3DIOL
PENTAN-2,3DIOL

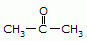
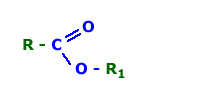 Onde R e R1 sao grupos de um ou mais carbonos ligados
Onde R e R1 sao grupos de um ou mais carbonos ligados.jpg)
 (parte circulada é cadeia principal)
(parte circulada é cadeia principal)
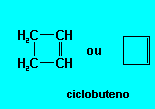
 --> Isso é um HEPTANO
--> Isso é um HEPTANO Isso é um ciclo hexano
Isso é um ciclo hexano